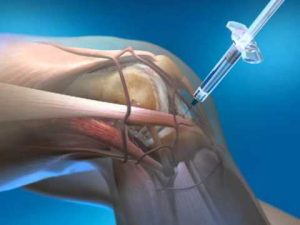
Le plasma riche en plaquettes (PRP) autologues, véritable concentré de facteurs de croissance du patient, est de plus en plus utilisé en médecine du sport notamment pour les lésions tendineuses. Même si les études pré-cliniques montrent des effets régénératifs incontestables sur de nombreux tissus, le manque d’études cliniques bien menées et le manque de standardisation du procédé de fabrication empêchent la communauté scientifique d’établir des recommandations. Actuellement en France, le cadre juridique du PRP reste à préciser. Une meilleure qualification biologique des produits injectés et un encadrement strict des pratiques sont indispensables à la bonne prise en charge des patients recevant ces nouvelles thérapeutiques prometteuses.
INTRODUCTION
Issus d’une simple prise de sang, les concentrés plaquettaires autologues comme le plasma riche en plaquettes, ont été développés à partir des années 1990 dans l’objectif de stimuler les différentes phases de la réparation tissulaire. En effet les injections de PRP augmentent les concentrations de facteurs de croissance plaquettaires au niveau du site lésionnel, entraînant une prolifération des fibroblastes, favorisant ainsi la cicatrisation tissulaire (1, 2). Leur caractère autologue leur confère, une parfaite biocompatibilité, tout en écartant le risque de transmission d’agents pathogènes. L’utilisation de PRP par des sportifs de renom tels que Tiger Woods ou Rafael Nadal a contribué à la médiatisation importante de cette nouvelle biothérapie.
D’un point de vue hématologique, le PRP est un concentré plaquettaire autologue, pouvant se définir comme un volume plasmatique restreint, contenant un fort contingent plaquettaire. Il est obtenu à partir de sang total prélevé sous anticoagulant, subissant une ou deux centrifugations, le débarrassant ainsi de la majorité des leucocytes et érythrocytes et de la phase plasmatique acellulaire riche en fibrine dénommée platelet poor plasma (PPP).
Il existe une grande hétérogénéité dans la composition qualitative et quantitative des différents PRP proposés actuellement aux cliniciens.
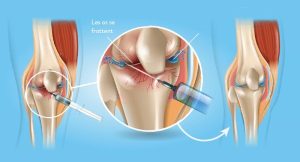
MÉTHODE DE PRÉPARATION
Parmi les nombreuses méthodes de préparation décrites, les plus utilisées en médecine du sport sont des techniques simplifiées basées sur une ou deux centrifugations du sang total.
Cette méthode a été exploitée par de nombreux fabricants qui proposent des kits commerciaux en système fermé. Certaines indications en stomatologie ou dermatologie nécessitent l’utilisation du PRP sous forme de gel. Une étape supplémentaire permet alors la transformation du PRP liquide en gel, en lui ajoutant du chlorure de calcium et de la thrombine ou de la batroxobine.
Les tarifs de kits proposés s’échelonnent de 60 € pour une injection sans aucune prise en charge par l’Assurance maladie, cependant, la pharmacie de l’hôpital de sens offre ce soin généreusement à nos patients.
Les thrombocytes étant des cellules sensibles, pour éviter leur activation in vitro, les étapes de préparation doivent se faire en évitant tout choc ou stress cellulaire, notamment lors des étapes de centrifugation et de remise en suspension. Un bon procédé de préparation de PRP doit concentrer suffisamment les plaquettes (2,5 à 7 fois le taux du sang total) mais en utilisant des vitesses de centrifugation assez faibles afin de ne pas les altérer avant leur injection au patient.
MÉCANISME D’ACTION
La suspension de plaquettes autologues est injectée dans le but d’obtenir leur activation au niveau du site lésionnel (au contact de surface collagénique). Les cytokines présentes dans le PRP sont alors massivement libérées à partir des granules α des plaquettes et exercent un effet positif sur la prolifération cellulaire. Ces facteurs de croissance provenant essentiellement des plaquettes et aussi des leucocytes résiduels ont des cibles et des fonctions spécifiques.
Au total, les injections de PRP s’accompagnent d’une augmentation de composés bioactifs in situ. Les diverses cytokines et facteurs de croissance issus des plaquettes autologues représentent un ensemble cohérent de signaux capables de stimuler la colonisation cellulaire et le remodelage des tissus lésés, premiers temps critiques de la cicatrisation et de la réparation cellulaire physiologique. Ces propriétés justifient leur intérêt croissant comme inducteurs de cicatrisation des tissus peu vascularisés et à faible activité mitotique.
A CHAQUE PROTOCOLE, UN PRP
De nombreux protocoles existent, mais les variations dans le nombre, la vitesse et le temps de centrifugation du sang, influencent considérablement la composition qualitative et quantitative des PRP (taux de plaquettes et de leucocytes résiduels). La dose optimale de plaquettes des PRP n’est que très peu étudiée dans la littérature. Les concentrations en plaquettes obtenues par les différents protocoles de préparation du PRP varient de 1,5 à 10 fois la concentration plaquettaire du sang périphérique. Un taux inférieur à 3 n’aurait pas d’effet et un taux supérieur à 7 aurait un effet paradoxal inhibiteur sur la régénération tissulaire (4, 5). Les vitesses de centrifugation élevées lors de la préparation du PRP peuvent altérer les fonctionnalités des plaquettes.
Les concentrations en facteurs de croissance ainsi que le degré d’activation plaquettaire en fin de process ne sont pas évalués dans la majorité des études. Le taux de leucocytes varie aussi selon les protocoles. Certains produits contiennent un faible taux de globules blancs (environ 1 G/l), alors que d’autres concentrent 2 à 4 fois les leucocytes par rapport au sang périphérique (environ 20 G/l). Deux théories s’affrontent à propos de l’intérêt des leucocytes dans le PRP : l’une préconise une forte concentration pour obtenir un effet antibactérien, l’autre au contraire ne la recommande pas afin d’éviter d’accentuer la réaction inflammatoire. Les caractéristiques biologiques parfois très différentes des PRP rendent difficiles la comparaison des études cliniques et leurs interprétations.
APPLICATIONS THÉRAPEUTIQUES
Les patients consultant les services de médecine du sport désirent un retour rapide à leur niveau de performance précédant la blessure. Le PRP peut ainsi, dans certaines indications leur permettre cette guérison rapide, en particulier sur des lésions localisées aux tendons, ligaments, muscles et cartilages (6).
Les tendinopathies
Caractérisées par des douleurs chroniques au niveau des tendons, les tendinopathies résultent d’un processus de dégénération tissulaire (7). Physiologiquement, les tendons possèdent un métabolisme de base faible qui les prédispose à un processus de cicatrisation lent après une lésion (8). Dans de nombreux cas, ces stratégies thérapeutiques offrent une alternative thérapeutique au traitement chirurgical dont les résultats sont souvent aléatoires, en particulier pour la reprise du même sport au même niveau.
Différentes études in vitro ont démontré que le PRP stimule l’expression génique et la synthèse de matrice dans les tendons et les cellules tendineuses se traduisant par une augmentation de la prolifération cellulaire et de la production de collagène total.
Quelques études cliniques sont disponibles dans la littérature, en particulier chez des patients présentant une épicondylite réfractaire au traitement de référence (9, 10), des tendinopathies achilléennes, des aponévrosites plantaires (11) ou plus récemment des tendinopathies patellaires (12). Certains auteurs concluent a un effet bénéfique des ces injections de PRP alors que d’autres ne relatent pas de différence par rapport au groupe placebo recevant des injections de sérum physiologique. La plupart de ces études sont critiquables sur le plan méthodologique : absence de groupe contrôle, effectif trop faible, absence de qualification biologique des produits injectés. Cependant c’est dans la prise en charge des tendinopathies que cette biothérapie semble avoir la plus grande place dans l’arsenal thérapeutique.
Reconstruction du ligament croisé antérieur
Il y a un intérêt croissant pour l’amélioration du taux de réussite de la ligamentoplastie du ligament croisé antérieur (LCA), en particulier en cas de défaillance du greffon.
Le retour complet à l’activité physique ne s’effectue pas avant 6 à 12 mois car la fixation biologique du greffon n’est assez forte pour subir une rééducation agressive qu’à partir de 12 semaines après la chirurgie (13).
L’utilisation du PRP, en accélérant le processus d’intégration du greffon permet aux patients de débuter un programme intensif de rééducation plus tôt et donc de reprendre leur sport plus rapidement que lors du traitement chirurgical traditionnel (6,14).
Gonarthrose
Le traitement des lésions cartilagineuses est limité et reste un véritable challenge. L’objectif du traitement est de diminuer la douleur, de limiter le retentissement fonctionnel ainsi que les répercussions sur les pratiques sportives et l’activité professionnelle notamment chez les sujets les plus jeunes. Les traitements conventionnels tels que les AINS, les anti-arthrosiques d’action lente comme le glucosamine sulfate et le chondroïtine sulfate, les injections intra-articulaires de corticoïdes ou d’acide hyaluronique restent parfois inefficaces. Le cartilage articulaire présente des propriétés physiologiques de réparation très limitées en raison d’une faible activité mitotique des chondrocytes et de l’absence de vascularisation.
Les capacités de régénération cartilagineuse, in vivo et in vitro, induites par les facteurs de croissance sont actuellement bien connues (15). L’apport de ces facteurs de croissance permet de stimuler la réparation cartilagineuse en favorisant la néovascularisation, la synthèse de collagène, et l’activation des chondrocytes. Les injections de PRP semblent être un traitement alternatif et innovant pour le traitement de ces lésions cartilagineuses (16). Des essais cliniques sont en cours pour valider ces premières données.
Autres indications
La médecine du sport offre un panel d’indications candidates à un traitement par PRP. Néanmoins la plupart de ces indications ne sont pas encore bien documentées.
EFFETS INDÉSIRABLES
A l’heure actuelle très peu d’études recensent les effets indésirables graves et non graves associés à l’administration de PRP.
Une étude préclinique chez des rats (17) rapporte un risque de fibrose tissulaire. Quelques études cliniques décrivent chez certains patients une douleur au point d’injection. En outre, il n’existe pas de rapports scientifiques suggérant d’éventuelles relations de cause à effet entre les facteurs de croissance présents dans le PRP et la carcinogenèse. En effet, les rares données de pharmacocinétiques (18, 19) disponibles montrent d’une part que les thrombocytes restent localisés au niveau du site d’injection et d’autre part que la demi-vie des facteurs de croissance est de quelques jours. De plus, le besoin limité d’injections (1 à 3 injections selon les auteurs) écarte ce risque.
Ces données ont été récemment confirmées par Wang-Saegusa (20) qui a injecté plus de 800 patients souffrant de gonarthrose sans aucun effet indésirable recensé 6 mois après l’injection.
CONCLUSION
Le plasma riche en plaquettes est un produit prometteur de par son origine autologue, sa simplicité d’obtention et son mécanisme d’action. Son utilisation dans les lésions des tendons et des ligaments a montré une récupération plus rapide sans effet indésirable significatif.
Toutefois, le manque d’étude clinique bien conduite et l’absence de standardisation des méthodes de préparation pour définir la composition exacte du produit empêchent d’établir des recommandations globales d’utilisation du PRP. Les autorités françaises doivent mieux encadrer son utilisation, notamment pour le traitement des tendinopathies au cabinet médical. Dans ce contexte, le PRP doit rester un produit de seconde ligne devant des pathologies réfractaires aux traitements conventionnels et il doit constituer une bonne alternative à la chirurgie en pesant favorablement sur la balance bénéfice/risque. L’utilisation de kits commerciaux facilite sa préparation et son utilisation, cependant la qualification biologique (au minimum la numération plaquettaire) est indispensable pour bien appréhender ce produit.